식품의약품안전처(처장 오유경)는 국산 코로나19 백신 개발을 지원하기 위해 ‘코로나19 백신 개발 시 고려사항’ 안내서(’20.6 제정)를 개정했다.
내용은 ➊추가접종 전용 코로나19 백신 개발 시 고려사항 신설, ➋다가 변이주 백신 개발 시 고려사항 신설, ➌연령대 확대 등 허가변경을 위한 임상 평가 시 고려사항 등이다.
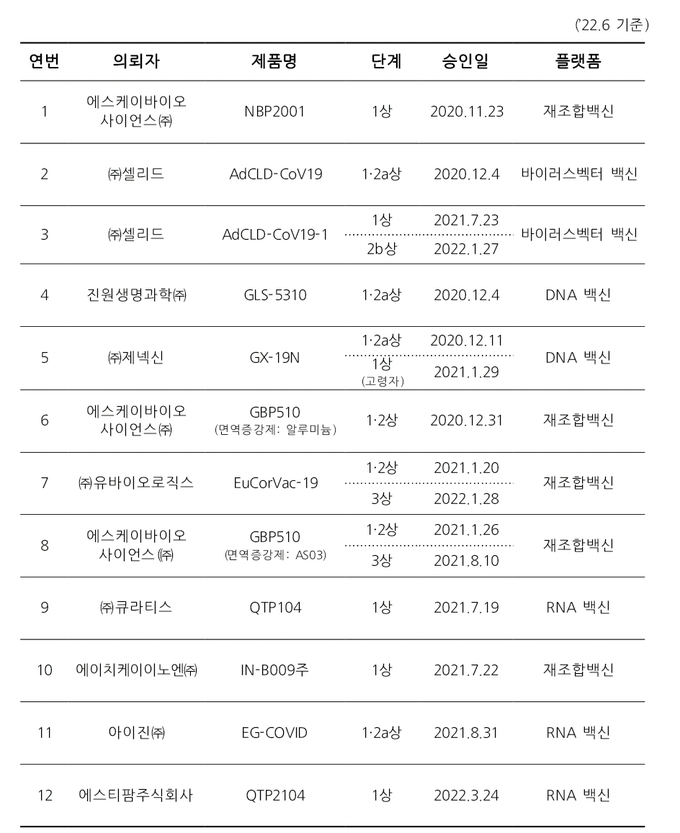
- 국내 개발 코로나19 백신 임상승인 현황
 -
-<➊ 추가접종 전용 코로나19 백신 개발 시 고려사항 신설
높은 백신 접종률, 오미크론 유행 등 코로나19의 역학적 변화에 따라 백신 미접종자나 코로나19 미감염자를 대상으로 한 기초접종 백신 개발이 어렵고 추가접종 전용 백신 개발 수요가 높은 것을 고려해 개발 시 고려사항에 대해 상세히 안내했습니다.
추가접종 전용 코로나19 백신에 대한 ▲비임상자료 요건 ▲임상시험 참여대상자 요건·규모 ▲대조백신 요건 등을 포함한 임상 설계 방법입니다.
기초접종 완료 후 추가접종 비임상 시험을 진행해야하나, 개발사 자체 백신으로만 최소 3회 이상 투여한 반복독성시험도 인정 가능하며, 면역 후 공격시험의 경우에는 초기 임상시험과 함께 진행할 수 있습니다.
대다수 국민이 예방접종을 완료했고 오미크론 변이가 유행하는 현 상황을 반영하여, 추가접종 임상시험 시 이미 허가된 백신을 접종받았거나, 코로나19 감염 이력이 있는 사람을 모집할 수 있습니다.
추가접종의 경우 3상 임상시험은 백신 접종자의 돌파 감염을 확인하는 유효성 임상이나 대조 백신과 면역원성을 비교하는 임상이 모두 가능하며, 이 경우 최소 3,000명 이상에서 안전성을 확인해야 합니다.면역원성 비교임상에 사용되는 대조백신은 허가된 추가접종용 백신을 선정하는 것을 권고합니다.
<➋ 다가 변이주 백신 개발 시 고려사항 신설
식약처는 다양한 코로나19 바이러스 변이가 유행함에 따라 두 개 이상의 코로나바이러스 항원이 포함된 다가 변이주 백신 개발에 대한 고려사항을 새롭게 마련했습니다. 내용은 ▲비임상자료 요건 ▲임상 평가 방법 ▲품질평가 자료 요건입니다.
다가 변이주 백신이 기초접종 백신과 같은 제조 플랫폼으로 동일 제조소에서 개발되고 전체 항원 함량이 기초접종 백신보다 같거나 적을 경우, 다가 변이주 백신의 효력시험자료만 새롭게 요구될 수 있습니다. 그 외 독성이나 분포시험 자료 등은 기존 기초접종 백신 자료를 활용할 수 있습니다.
기초접종 백신을 참고해 임상을 평가할 수 있습니다. 면역원성을 분석할 때는 다가 변이주 백신에 포함된 항원에 해당하는 모든 변이주를 분석해야 합니다.
다가 변이주 백신이 하나의 바이알에 충전될 경우, 각 항원의 제조방법을 포함한 품질자료가 제출되어야 합니다. 또한 각 항원이 역가나 함량시험 결과에 영향을 주지 않는다는 것이 확인되어야 합니다.
➌ 허가사항 변경을 위한 임상 평가 시 고려사항 신설
식약처는 허가받은 백신의 추가접종이나 연령대 확대 등 허가사항변경을 위한 임상 평가 시 고려사항을 추가로 마련했습니다.
내용은 ▲기초접종 이후 추가접종(3차 혹은 4차)을 위한 임상 평가 시 고려사항 ▲접종 대상 연령 확대를 위한 임상 평가 시 고려사항입니다.
추가접종을 하고자 하는 백신으로 먼저 기초접종하고 일정 간격 이후 동일한 백신으로 추가접종을 한 뒤 기초접종과 추가접종의 중화항체가 증가비율과 혈청반응률 차이를 평가할 수 있도록 설계해야 합니다. 변이주에 대한 평가도 수행되어야 합니다.
소아로 접종 연령을 낮추고자 하는 경우, 해당 연령층에 대한 최적 용량을 확인하는 임상시험이 권장됩니다. 이와 함께 안전성·효과성이 확인된 백신을 접종한 성인에서의 면역원성과 비교하여 소아연령층의 안전성·효과성을 확인해야 합니다.














