국제적 수준의 임상평가를 통과한 혁신 의료기기가 별도의 신의료기술평가 절차 없이 의료현장에서 즉시 사용될 수 있는 길이 열렸다.
보건복지부와 식품의약품안전처는 의료기기 허가 단계에서 강화된 임상평가를 거친 의료기술에 대해 신의료기술평가를 면제하는 ‘시장 즉시진입 의료기술’ 제도를 도입하고, 관련 법령 개정이 완료됨에 따라 2026년 1월 26일부터 본격 시행한다고 밝혔다. 이에 따라 최장 490일이 소요되던 의료기술의 시장 진입 기간은 최단 80일까지 대폭 단축된다.
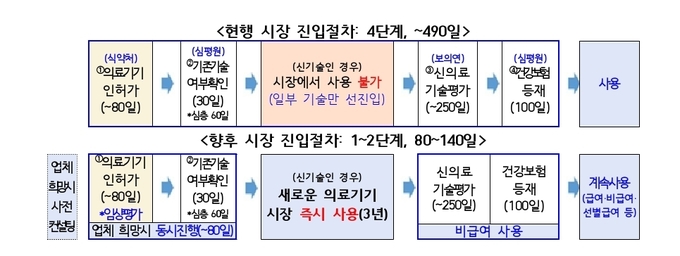
신의료기술평가는 새로운 의료기술이 의료현장에서 사용되기 전 반드시 거쳐야 하는 절차로, 안전성과 유효성 검증을 핵심으로 한다. 그간 정부는 의료기기 산업 활성화와 우수 기술의 조기 도입을 위해 평가 유예 제도 등을 운영해 왔으나, 절차의 복잡성과 장기간 소요 문제로 현장 활용에는 한계가 있다는 지적이 이어져 왔다.
이에 보건복지부와 식약처는 협업을 통해 의료기기 허가 단계에서 이미 국제적 수준의 강화된 임상평가를 받은 의료기기를 활용하는 의료기술에 대해서는 별도의 신의료기술평가 없이 곧바로 시장에 진입할 수 있도록 제도를 개선했다. 이를 위해 「신의료기술평가에 관한 규칙」과 「의료기기 허가·신고·심사 등에 관한 규정」을 동시에 개정했다.
개정 제도에 따르면, 혁신적 의료기술로서 식약처의 강화된 임상평가를 거친 의료기기를 사용하는 의료기술은 ‘시장 즉시진입 의료기술’로 규정된다. 해당 기술은 건강보험심사평가원에 기존기술 여부 확인을 거쳐 기존기술이 아닌 것으로 판단될 경우, 보건복지부 장관 고시를 통해 즉시 의료현장에서 사용할 수 있다. 즉시진입 기술은 최대 3년간 사용이 가능하며, 이후 신의료기술평가 및 건강보험 급여 여부 판단을 통해 지속 사용 여부가 결정된다.
다만 비급여 남용을 방지하고 환자 부담을 완화하기 위해, 즉시진입 사용 기간 중에도 필요 시 보건복지부 장관 직권으로 신의료기술평가를 실시하고 급여 여부를 결정할 수 있는 근거도 마련됐다.
식약처는 이번 제도 시행을 뒷받침하기 위해 신의료기술평가 유예 적용 대상 의료기기 공고 근거와 임상평가자료 제출 기준을 신설했다. 허가 신청 시 임상시험 자료뿐 아니라 시판 후 실사용 자료, 국내·외 유사 기기의 임상 경험, 객관적·과학적 임상 문헌자료 등 국제적 수준의 임상평가자료 제출이 요구된다.
아울러 식약처는 보건복지부와 협의를 거쳐 시장 즉시진입 의료기술 대상 의료기기 품목 199개를 공고했다. 대상에는 인공지능(AI) 기반 디지털의료기기 등 113개 품목의 디지털의료기기, 체외진단시약 83개 품목, 자동화시스템 로봇수술기와 전동식 외골격장치 등 의료용 로봇이 포함됐다.
곽순헌 보건복지부 보건의료정책관은 “새로운 의료기기의 시장 진입 절차를 간소화해 의료기기 산업을 활성화하고, 우수한 의료기기의 조기 현장 도입을 지원하겠다”며 “안전하지 않은 의료기술은 철저히 관리하고, 비급여 사용 현황을 지속적으로 모니터링해 제도가 의료현장에 안정적으로 정착될 수 있도록 관계기관과 협력하겠다”고 밝혔다.














