
고려대학교 의과대학 융합의학교실 이현지 교수 연구팀이 서울대학교 수의과대학, ㈜엣진과의 공동 연구를 통해 세계 최초로 레버씨 시신경 위축증(Leber Hereditary Optic Neuropathy, LHON)의 유전자 교정 치료에 성공했다. 이번 성과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications)*에 게재되며 전 세계적으로 높은 주목을 받고 있다.
레버씨 시신경 위축증은 모계유전되는 대표적인 미토콘드리아 질환으로, 시신경세포가 급속히 퇴행해 중심시야 소실 및 실명을 유발하는 희귀 유전질환이다. 주로 105만 명 이상이 이 질환으로 시력을 잃은 것으로 추정된다.
주요 원인은 미토콘드리아 DNA(mtDNA)의 복합체 I 유전자(MT-ND4·ND1·ND6 등) 변이로, 그중 **MT-ND4의 m.G11778A 변이가 전체 환자의 약 70%를 차지한다. 그러나 미토콘드리아 막 특성상 기존 CRISPR 가이드 RNA가 진입할 수 없어 정밀 유전자 치료는 사실상 불가능했다. 현재 승인된 유일한 약물 이데베논(Idebenone) 역시 기능 보조 수준에 머물러 근본적 치료에 한계가 있었다.
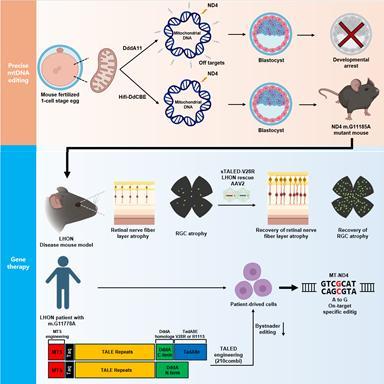
■ “동물 모델 구축부터 교정 치료까지”… 근본 치료 가능성 첫 실증
연구팀은 미토콘드리아 염기교정 기술 ‘High-Fidelity DdCBE(Hifi-DdCBE)’를 이용해 사람의 대표 변이인 MT-ND4 G11778A와 대응하는 m.G11185A 변이를 생쥐에서 성공적으로 구현했다. 이를 통해망막 시신경층 두께 감소,시신경세포 수 감소,시기능 저하 등 실제 LHON 환자와 동일한 병리적 특징을 보이는 정밀 동물 모델을 구축했다.
이어 2024년 Cell에 보고했던 차세대 교정 기술 **‘TALED-V28R’(정밀도 향상 TALE-linked deaminase)**을 아데노부속바이러스(AAV)로 전달하는 방식의 치료를 적용했다. 유리체 내 주사 후 AAV-TALED V28R은 시신경세포로 전달돼 돌연변이 mtDNA를 정상 염기로 교정했고, 그 결과 손상된 망막 두께가 정상 수준으로 회복,시신경세포 수 증가,OKN·ERG 기반 시각 기능 유의미하게 개선 이라는 획기적 결과가 확인됐다.
또한 TALED V28R을 LHON 환자 유래 세포에 적용했을 때도 ATP 생성 및 미토콘드리아 복합체 I 활성이 회복돼 임상 적용 가능성을 입증했다.

■ 연구팀 “미토콘드리아 질환 치료의 새로운 전환점”
공동 제1저자인 김상훈 박사과정생은 “치료제가 없어 고통받는 환자들에게 새로운 희망이 될 것”이라며 “미토콘드리아 유전자 교정 기술을 더욱 고도화해 실제 임상에 도입할 수 있도록 연구를 이어가겠다”고 밝혔다.
공동 교신저자인 이현지 교수는 “이번 연구는 세계 최초로 미토콘드리아 질환 생체 모델에서 유전자 교정 치료 효과를 실증한 사례”라며 “LHON을 비롯한 다양한 미토콘드리아 유전질환의 근본적 치료제 개발이 실제 임상 단계로 도약하는 계기가 되기를 기대한다”고 강조했다.
이번 연구는 Nature Communications(IF 15.7)에‘In Vivo Mitochondrial Base Editing Restores Genotype and Visual Function in a Mouse Model of LHON’이라는 제목으로 게재됐다. 연구팀의 성과는 미토콘드리아 유전질환의 본격적인 유전자 교정 치료 시대를 여는 중요한 이정표로 평가받고 있다.
-













