문정림 의원(보건복지위원회, 새누리당)이 2014년 국정감사를 위해, 식품의약품안전처(이하 식약처)로부터 제출받은 자료를 분석한 결과, 2013년 한국의약품안전관리원에 중대한 유해사례(사망)로 보고된 총 1,587건 중 45건(2.8%)만 인과관계 가능성이 있는 반면, 선천성 기형으로 보고된 총 6건 모두 보고자 보고 오류로 밝혀졌다.
<중대한 유해사례/약물유해반응 보고 현황(‘10년~’14.6월)>
|
|
’10년 |
’11년 |
’12년 |
’13년 |
’14년 6월 | |
|
중대한 이상약물 보고 |
8,284 |
9,521 |
11,110 |
14,112 |
6,384 | |
|
유 형 |
사망 |
1,264 |
1,290 |
1,455 |
1,587 |
628 |
|
입원 또는 입원기간의 연장 |
4,499 |
5,361 |
5,896 |
7,315 |
3,452 | |
|
선천적 기형 초래 |
1 |
3 |
0 |
6 |
24 | |
|
생명의 위협 |
372 |
0 |
116 |
478 |
308 | |
|
중대한 불구나 기능저하 |
80 |
126 |
121 |
234 |
137 | |
|
기타 의학적으로 중요한 상황 |
2,220 |
3,606 |
4,401 |
5,628 |
2,423 | |
* 주 : 중대한 이상반응 보고 1건에 2개 이상의 유형이 보고될 수 있음
<보고된 사망 및 선천성 기형사례에 대한 처리절차>
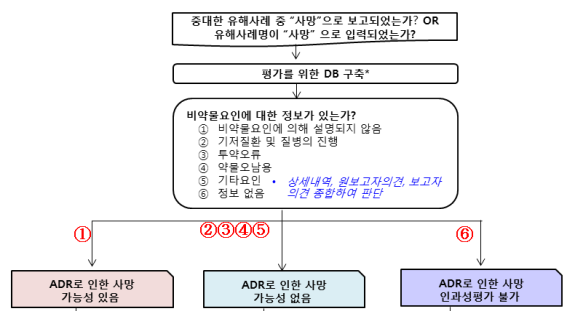
<2013년 보고내용에 대한 사망평가 결과>
|
구분 |
13년 보고건수 |
중복 보고 제거후 |
검토 결과 | |||||
|
평가 불가 |
가능성 없음 |
가능성 있음 | ||||||
|
⑥ 정보 없음 |
② 기저질환 |
③ 투약오류 |
④ 약물 오남용 |
⑤ 기타요인 |
① 비약물요인에 의해 설명되지 않음 | |||
|
사망 |
1,587 |
1,249 |
382 |
797 |
2 |
5 |
18 |
45 |
<‘13년 중대한 이상사례(사망) 보고건 중 의약품과 이상사례간 인과관계 평가 결과, “가능성 있음”에 대한 평가 현황(45건)>
|
순번 |
보고원 |
의약품(성분명) |
이상사례 |
|
1 |
제약회사 |
prednisolone, leflunomide, hydroxychloroquine |
폐렴, 패혈증, 결핵균감염, 다발기관부전 |
|
2 |
제약회사 |
cabazitaxel |
패혈증 |
|
3 |
제약회사 |
insulin aspart |
설사, 췌장염, 고혈당증, 호흡곤란 |
|
4 |
제약회사 |
rifampicin, pyrazinamide, ethambutol, isoniazid |
발진, 급성신부전, 아나필락시스성쇼크, 파종혈관내응고, 횡문근융해 |
|
5 |
제약회사 |
doxorubicin, prednisolone, vincristine, rituximab, cyclophosphamide |
간실조, 바이러스성간염 |
|
6 |
제약회사 |
doxorubicin, prednisolone, vincristine, rituximab, cyclophosphamide |
간실조, 바이러스성간염 |
|
7 |
제약회사 |
doxorubicin, prednisolone, vincristine, rituximab, cyclophosphamide |
폐렴, 간실조, 바이러스성간염, 만성신부전 |
|
8 |
제약회사 |
rituximab |
간염, 간실조 |
|
9 |
제약회사 |
rituximab |
간염, 간실조, 바이러스성간염 |
|
10 |
제약회사 |
netilmicin, ceftriaxone, lidocaine, isosorbide dinitrate, furosemide, dopamine, labetalol, mannitol, metoclopramide, acetylcysteine, albumin, potassium, ranitidine, nicardipine, vecuronium, suxamethonium, lactulose, ketorolac, carvedilol, etomidate, phenylephrine, rosuvastatin, pethidine, remifentanil, pantoprazole, perindopril, heparin, methylprednisolone, Other drugs for disorders of the musculo-skeletal system, acetylsalicylic acid, hydroxyethylstarch, clarithromycin |
출혈성뇌졸중 |
|
11 |
의료기관 |
Other drugs affecting bone structure and mineralization |
아나필락시스성쇼크 |
|
12 |
제약회사 |
thiamazole |
폐출혈 |
|
13 |
제약회사 |
iopromide |
아나필락시스성쇼크 |
|
14 |
제약회사 |
gadobutrol |
아나필락시스성쇼크 |
|
15 |
제약회사 |
rivaroxaban |
위장관출혈, 뇌출혈 |
|
16 |
제약회사 |
acetylsalicylic acid, furosemide, carvedilol, spironolactone, clopidogrel |
급성신부전 |
|
17 |
제약회사 |
acetylsalicylic acid, furosemide, platelet aggregation inhibitors excl. heparin, carvedilol, memantine, gadobutrol |
땀증가, 요저류, 졸림, 설사, 저혈압, 창백, 구토, 오심, 청색증, 폐부종, 저체온증 |
|
18 |
제약회사 |
fludarabine, antithymocyte immunoglobulin (rabbit), cyclophosphamide |
과립구성백혈병 |
|
19 |
제약회사 |
fludarabine, antithymocyte immunoglobulin (rabbit), cyclophosphamide |
골수증식질환 |
|
20 |
제약회사 |
fludarabine, antithymocyte immunoglobulin (rabbit), cyclophosphamide |
간정맥혈전증 |
|
21 |
제약회사 |
doxorubicin, prednisolone, vincristine, rituximab, cyclophosphamide |
기이한약물반응 |
|
22 |
제약회사 |
doxorubicin, prednisolone, vincristine, rituximab, cyclophosphamide |
기이한약물반응 |
|
23 |
제약회사 |
doxorubicin, prednisolone, vincristine, rituximab, cyclophosphamide |
기이한약물반응 |
|
24 |
제약회사 |
doxorubicin, prednisolone, vincristine, rituximab, cyclophosphamide |
기이한약물반응 |
|
25 |
제약회사 |
doxorubicin, prednisolone, vincristine, rituximab, cyclophosphamide |
기이한약물반응 |
|
26 |
제약회사 |
doxorubicin, prednisolone, vincristine, rituximab, cyclophosphamide |
기이한약물반응 |
|
27 |
의료기관 |
itraconazole |
저혈압 |
|
28 |
의료기관 |
gentamicin, doxycycline, clobetasol, prednicarbate, ANTIHISTAMINES FOR SYSTEMIC USE, desoximetasone, Propulsives, levocetirizine, clobetasol |
스티븐스-존슨증후군 |
|
29 |
의료기관 |
azathioprine |
범혈구감소증 |
|
30 |
의료기관 |
azathioprine |
범혈구감소증 |
|
31 |
의료기관 |
doxorubicin |
심근병증 |
|
32 |
의료기관 |
warfarin |
응고장애 |
|
33 |
의료기관 |
allopurinol |
스티븐스-존슨증후군 |
|
34 |
의료기관 |
doxorubicin, cyclophosphamide, vincristine, rituximab |
패혈증, 백혈구감소증 |
|
35 |
제약회사 |
iodixanol |
구토, 오심, 심장정지 |
|
36 |
제약회사 |
H2-receptor antagonists, aceclofenac, Other drugs affecting bone structure and mineralization, oxycodone, combinations |
혼수, 부정맥, 호흡곤란, 아나필락시스성쇼크, 사망 |
|
37 |
제약회사 |
dabigatran etexilate, |
급성신부전 |
|
38 |
제약회사 |
heparin, ticagrelor |
뇌출혈 |
|
39 |
제약회사 |
hydrochlorothiazide, magnesium oxide, acetylsalicylic acid, codeine, combinations excl. psycholeptics, gefitinib, amlodipine |
폐렴 |
|
40 |
제약회사 |
acetylsalicylic acid, clopidogrel, platelet aggregation inhibitors excl. heparin |
뇌출혈 |
|
41 |
제약회사 |
acetylsalicylic acid, cilostazol, , icorandil, carvedilol, atorvastatin, clopidogrel, diltiazem, trimetazidine |
거미막하출혈 |
|
42 |
한국의약품안전관리원 의약품부작용신고센터 |
Various alimentary tract and metabolism products (한중반하백출천마탕엑스과립) |
복통, 사망 |
|
43 |
한국의약품안전관리원 의약품부작용신고센터 |
hyaluronic acid |
기침, 무력증, 수분섭취감소 |
|
44 |
제약회사 |
carboplatin, paclitaxel |
과립백혈구감소증, 패혈증, 고암모니아혈증 |
|
45 |
제약회사 |
Bisphosphonates, combinations |
사망, 대장염, 변비, 복통 |
* 의약품과 이상사례간 인과관계 평가(가능성 있음)는 의료기관에 대한 현장조사 없이 보고된 자료의 상세내용(기저질환 및 질병의 진행 등)을 바탕으로 보고자 의견을 종합하여 판단한 결과임
식약처는 의약품에 의한 ‘중대한 유해사례 보고’가 매년 지속적으로 증가하고, 매월 100건 이상의 사망 사례가 보고되고 있는 상황에서 국민 불안을 해소하고, 국민에게 정확한 정보 전달을 위해 이에 대한 인과관계 확인 등 구체적인 조사, 분석이 이미 이루어졌어야 함에도 불구하고, 의약품 안전 관리 책임을 맡고 있는 식약처는 ‘중대한 유해사례’에 대한 처리 매뉴얼(국내 의약품등 중대한 유해사례 정보의 분류 및 처리기준)에 따른 현황 파악․분석을 제대로 하고 있지 않았다.
이에 문정림 의원실은 중대한 유해사례 보고 현황 파악·분석을 직접 실시하고자, 식약처에 관련 자료를 요구하였으나, 식약처는 요구시마다 답변자료를 새롭게 작성하여 제출하였고, 제출자료에서 새로운 오류보고가 계속적으로 발견되었다.
특히, ‘중대한 유해사례보고 처리 기본 원칙’상 중대한 유해사례 처리는 일별, 주별, 월별 검토하도록 되어 있으나, 식약처 담당자는 1년에 한번 평가한다며 2014년 10월 6일 현재에도 ‘2014년 보고내용에 대한 사망 인과관계 등 평가는 전혀 이루어지지 않았다’는 답변만 반복했다.
또한 2013년부터 2014년 6월까지 부작용 정보 수집․분석․평가에 따른 안전조치 실적을 확인한 결과, 중대한 이상 약물 유해보고가 2만건이 넘는데도 불구하고, 식약처는 실데나필(비아그라정 등), 아세트아미노펜(어린이 타이레놀 현탁액 등) 등 총 12개 성분(736개 제품)에 대해서만 허가사항 변경 지시를 했다고 답했다.
<부작용 정보 수집․분석․평가에 따른 안전조치 실적(’13년~’14.6월)>
|
연번 |
성분(품목) |
제품수 |
허가변경 지시일 |
허가사항 변경 내용 |
|
1 |
메토클로프라미드 (경구제및주사제) |
6 |
2013.4.26. |
국내 부작용 보고자료의 분석·평가에 따라 아래 이상반응 추가 1. 소화기계 : 오심, 구토 2. 추체외로증상 : 저린증상 등 감각이상 3. 기타 : 가슴통증 |
|
2 |
아리피프라졸 |
28 |
2013.4.26. |
국내 부작용 보고자료의 분석·평가에 따라 아래 이상반응 추가 1. 근골격계 : 등통증, 2. 호흡기계 : 코피 3. 눈 : 건성안, 5. 생식기계 : 사정장애 |
|
3 |
반코마이신(주사) |
59 |
2013.9.13. |
국내 부작용 보고자료의 분석·평가에 따라 아래 이상반응 추가 1. 피부 : 반점구진발진, 자반성발진, 소포성발진 2. 간담도계 : 황달, 3. 주사부위 : 발진 |
|
4 |
타크로리무스 (경구제및주사제) |
17 |
2013.4.26. |
국내 부작용 보고자료의 분석·평가에 따라 아래 이상반응 추가 1. 근골격계 : 다리통증 2. 혈액계 : 순수적혈구무형성증(경구제에만해당함) 3. 위장관계 : 위식도역류 |
|
5 |
실데나필 |
90 |
2013.9.13. |
국내 부작용 보고자료의 분석·평가에 따라 다음 이상반응 추가(눈 : 유루) |
|
6 |
아세트아미노펜 |
113 |
2013.9.13. |
국내 부작용 보고자료의 분석·평가에 따라 아래 이상반응 추가 1. 간담도계 : AST상승, ALT상승 2. 피부 : 고정발진 |
|
7 |
시프로플록사신 |
121 |
2013.9.13. |
국내 부작용 보고자료의 분석·평가에 따라 아래 이상반응 추가 1. 피부 : 반점구진발진, 자반성발진 2. 주사부위 : 발진, 가려움, 두드러기 |
|
8 |
세툭시맙 |
1 |
2013.9.13. |
국내 부작용 보고자료의 분석·평가에 따라 다음 이상반응 추가(소화기계: 복통, 낭성장기종) |
|
9 |
아세클로페낙 |
94 |
2013.9.13. |
국내 부작용 보고자료의 분석·평가에 따라 아래 이상반응 추가 1. 피부 : 혈관부종, 2. 기타 : 말초부종, 눈주위부종 |
|
10 |
에탐부톨 |
6 |
2013.9.13. |
국내 부작용 보고자료의 분석·평가에 따라 아래 이상반응 추가 1. 전신 : DRESS증후군 2. 피부 : 반점구진발진, 3. 혈액계 : 호산구증가증 |
|
11 |
탈리도마이드 |
7 |
2013.9.13. |
국내 부작용 보고자료의 분석·평가에 따라 다음 이상반응 추가(이 약 복용 환자는 대부분 면역기능이 저하되어 있어 감염성 질환(대상포진)이 나타날 수 있음) |
|
12 |
발사르탄/암로디핀 |
194 |
2014.2.21. |
국내 부작용 보고자료의 분석·평가에 따라 아래 이상반응 추가 1. 전신이상 : 가슴통증 |
문정림 의원은, “2013년 한 해에만 14,000건이 넘는 중대한 유해사례가 보고되어 약물 부작용에 대한 불안감을 가질 수밖에 없다”며, “사망사례도 1,500건이 넘는 자발적 보고가 이루어지고 있는 상황에서, 보고된 부작용의 정도, 부작용 발생 빈도, 사회적 관심도 등을 고려하여 보고된 정보를 신속히 분석․평가하고, 안전조치를 하는 등 체계적이고 적극적인 조치를 취해야만 한다”고 지적했다.
이어서 문정림 의원은 “식약처는 ‘한국의약품안전관리원’으로부터 보고받은 자료분석을 전혀 하지 않은 것은 물론이고, 입법부의 자료제출 요구에 매번 다른 자료, 부정확한 자료를 내놓고, ‘한국의약품안전관리원’ 등 산하기관으로 미루는 등 의약품 안전관리에 관한 최종 책임을 져야하는 국가기관의 모습을 전혀 보여주지 않았다”며, “의약품 부작용으로부터 국민의 건강과 생명을 보호하고 국민의 불안감 해소를 위해 식약처는 책임감있게 업무를 수행해야만 한다”고 당부했다.













