
‘제약강국을 위한 지속가능 혁신경영’을 2022년 새해 경영슬로건으로 선포한 한미약품그룹이 임인년 한해를 이끌어 갈 R&D 신규 전략을 공개했다.
한미약품(대표이사 권세창·우종수)의 신약개발 부문 총괄 책임자인 권세창 사장은 10~13일 온라인으로 열린 제40회 JP모건 헬스케어 컨퍼런스에서 현재 개발중인 30여개 신약 파이프라인을 포함한 신규 R&D 계획을 13일 발표했다.
이날 발표에서 권 사장은 연내 미국 FDA 시판허가를 목표로 하고 있는 롤론티스(호중구감소증 치료 바이오신약)와 포지오티닙(항암 혁신신약)을 비롯한 다양한 파이프라인을 소개하는 한편, 최근 성공적으로 확보한 mRNA 플랫폼 기반의 다양한 신약개발 전략도 공개했다.
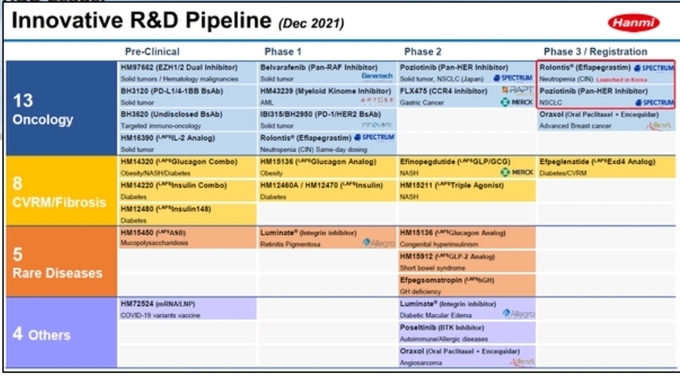
한미약품은 현재 항암분야 13개, 대사성질환 및 심혈관∙신장계(CVRM) 질환 8개, 희귀질환 5개, 기타 영역 4개 등 30여개에 이르는 혁신신약 개발을 진행하고 있다. 한미약품 임직원의 25% 이상인 600여명의 R&D 인력이 이 연구개발에 몰두하고 있다.
한미약품은 글로벌 제약사와의 파트너십은 물론 벤처기업과 연구소, 대학교 등과도 활발한 오픈이노베이션을 진행하고 있으며, 면역항암, 염증∙섬유화, 중추신경계(CNS)∙희귀질환, 신규 치료기전(modality) 등 의학적 미충족 수요가 높은 4개 분야를 오픈이노베이션 핵심 개발분야(Focused Area)로 지정했다.
권 사장은 “항암과 희귀질환 등 분야에서 30여개 혁신신약 파이프라인을 구축한 한미약품은 최근 성공적으로 확보한 mRNA 플랫폼을 기반으로 더욱 확장된 미래가치를 구축해 나갈 것”이라며 “그동안 축적해 온 한미의 R&D가 결실을 맺는 2022년이 될 수 있도록 최선을 다하겠다”고 말했다.
◆항암 분야에서는 롤론티스, 포지오티닙 연내 FDA 허가 기대
한미약품은 파트너사 스펙트럼이 개발중인 롤론티스와 포지오티닙의 FDA 시판허가가 올해 기대된다고 밝혔다. 스펙트럼은 올해 1분기 중 FDA에 롤론티스에 대한 생물의약품허가(BLA)를 재신청할 계획이며, 포지오티닙에 대해서는 작년 12월 FDA 시판허가 신청을 완료해, 두 제품 모두 이르면 연내 허가 승인이 예상된다. 한미약품은 최근 이 두 신약의 높은 상용화 가능성에 대한 기대에 따라 스펙트럼에 대규모 지분 투자를 단행한 바 있다.
나스닥 상장사인 혈액질환 전문 제약사 앱토즈에 5000억원대로 기술수출 된 경구용 골수키놈억제제(MKI, myeloid kinome inhibitor, HM43239)의 임상도 올해 본격화한다. HM43239는 2018년 미국 FDA로부터, 이어 2019년 한국 식약처로부터 희귀의약품으로 지정된 바 있으며, 미국과 한국에서 임상 1상이 빠르게 진행되고 있다. 앱토즈는 현재 진행중인 임상 결과를 토대로 최대한 신속하게 후속 임상을 이어갈 계획이다.
HM43239는 기존 치료제에 불응성을 보여 치료에 실패한 환자에서 골수아세포(BM Blast)가 5% 미만으로 감소되고 혈구 수치가 정상으로 회복되는 상태인 완전관해를 유도하는 효과가 확인됐다. 일부 환자들은 완치를 위한 자가조혈모세포 이식까지 가능한 상태로 회복되기도 했다.
2016년 기술수출돼 로슈의 자회사 제넨텍이 개발중인 표적 항암신약 벨바라페닙의 미래가치도 지속적으로 상승하고 있다. 현재 제넨텍은 벨바라페닙의 NRAS melanoma 적응증에 대한 글로벌 임상 1b상을 진행하고 있다. 또한 제넨텍 모회사인 로슈는 자사의 핵심 파이프라인을 선정해 진행하는 대규모 임상 연구과제(TAPISTRY)에 벨바라페닙을 포함시켰고, BRAF class 2, class 3, 또는 fusion 돌연변이 고형암 환자 50명을 대상으로 '벨바라페닙' 단독 투여 임상을 진행하고 있다.
이번 발표에서는 한미약품이 불응성 악성 혈액암 및 고형암의 새 표적항암 신약으로 개발중인 EZH1/2 이중 저해제(HM97662) 임상 전략도 처음 소개됐다. 한미약품은 올해 상반기 임상 1상 신청을 계획중이며, 연내 용량증량 및 확장 임상까지 확대할 방침이다.
HM97662는 전임상 연구에서 다수의 재발 혹은 불응성 암종 돌연변이 또는 과발현된 발암 유전자 EZH2의 억제는 물론, 상보적으로 활성화되는 EZH1 억제 능력도 우수한 이중 저해로 강력한 항암 효과의 가능성을 보이고 있다.
이와 함께 북경한미약품에서 개발한 이중항체 플랫폼 펜탐바디(PENTAMBODY)가 적용된 신약들도 개발에 속도를 내고 있다. 펜탐바디는 하나의 항체가 서로 다른 2개의 표적에 동시에 결합할 수 있는 차세대 항체 기술이다. 면역글로불린G와 유사한 구조이기 때문에 면역원성 및 안정성 등이 우수하고 생산 효율도 높다.
현재 북경한미약품은 펜탐바디 기술이 접목된 5개 주요 이중항체 신약 연구를 진행하고 있는데, 이 중 임상1상 품목인 BH2950(PD-1/Her2 이중항체)은 이노벤트와 공동개발 파트너십을 통해 중국 고형암 환자 대상 임상 1상 용량 증량(dose escalation)을 성공적으로 마쳤다. 용량제한독성(DLT)과 최대내성용량(MTD)이 관찰되지 않았으며, 1상 데이터를 기반으로 현재 용량 확장(does expansion) 임상이 진행되고 있다.
◆NASH, 비만·당뇨 등 대사성 질환 분야 혁신 기대
GLP-1 수용체와 글루카곤 수용체, GIP 수용체를 동시에 활성화하는 삼중 작용제 LAPSTriple Agonist(HM15211)는 생검(biopsy)으로 확인된 간섬유화를 동반한 NASH 환자 대상 후기 글로벌 임상 2상(P2b)에서 강력한 지방간 감소효과가 입증돼 향후 새로운 혁신 창출이 기대되고 있다. FDA는 LAPSTriple Agonist를 NASH 치료를 위한 패스트트랙 개발 의약품으로 지정했으며, NASH 외에도 희귀질환인 원발 담즙성 담관염과 원발 경화성 담관염, 특발성 폐섬유증 치료를 위한 희귀의약품으로도 지정했다. 최근 유럽 EMA도 이 약을 원발 경화성 담관염 치료를 위한 희귀의약품으로 지정했다.
2020년 미국 MSD에 기술수출된 이중작용 치료제 에피노페그듀타이드는 두 자릿수 이상의 체중감소 효과를 토대로 현재 NASH 임상 2a상이 진행되고 있다. 에피노페그듀타이드는 인슐린 분비 및 식욕억제를 돕는 GLP-1과, 에너지대사량을 증가시키는 글루카곤을 동시에 활성화한다.
GLP-1 수용체 작용제 당뇨치료제인 에페글레나타이드는 주 1회까지 투여 주기를 늘린 바이오신약이다. 제2형 당뇨병을 가진 저위험 및 고위험군 환자 모두에서 혈당, 혈압 그리고 체중감소 효과를 입증했다.
특히 28개국 344개 지역에서 제2형 당뇨환자 혹은 심혈관 질환 환자 4076명을 대상으로 에페글레나타이드 4mg 또는 6mg 용량을 단독 투여한 대규모 글로벌 3상 연구인 AMPLITUDE-O를 통해 위약 투여군 대비 주요 심혈관계 사건 발생율은 27%, 신장질환 발생율은 32% 감소한 결과를 도출했다.
우수한 심혈관계(MACE) 사건 위험도 감소 효과 및 신장계에서의 우수한 안전성은 물론, exendin-4 기반의 GLP-1 수용체 작용제로는 최초로 3-point MACE(심혈관 사망, 심근경색, 뇌졸중)를 감소시키는 점도 입증했다. 또한 타 GLP-1 제제와 비교해 유사한 혈당조절 및 우수한 위장관계(GI) 안전성도 나타났다. 한미약품은 이번 대규모 글로벌 3상 결과를 바탕으로, 새로운 혁신 창출을 위한 다각적 노력을 진행하고 있다.◆희귀질환 분야 혁신신약, 한미 신성장동력 ‘주목’
한미약품은 국내 제약사 최다 희귀의약품 지정을 바탕으로 올해 난치성 희귀질환 분야에서 새로운 성과 창출을 기대하고 있다.
미국 FDA와 유럽 EMA, 한국 식약처로부터 국내 제약사 중 가장 많은 총 18건의 희귀의약품 지정을 받은 한미약품은 단장증후군, 선천성 고인슐린혈증, 리소좀 축적질환 등 소수의 환자에게 발병하는 희귀질환 치료제 개발에 힘쓰고 있다.
5만명 중 한명 꼴로 발병하는 선천성 고인슐린혈증 치료제로 개발중인 LAPSGlucagon Analog(HM15136)는 체내 포도당 합성을 촉진하는 글루카곤의 짧은 반감기와 생체 유사 환경에서의 부족한 용해도·안정성을 획기적으로 개선한 세계 최초의 주 1회 투여 글루카곤 후보물질이며, 현재 글로벌 임상 2상이 진행 중이다. 개선된 체내 지속성과 우수한 융모세포 성장 촉진 효과를 바탕으로 세계 최초 월 1회 투여를 목표로 개발중인 LAPSGLP-2 Analog(HM15912)는 최근 단장증후군 환자 대상 단독 요법 글로벌 임상 2상에 착수했다.
◆글로벌 오픈이노베이션 통한 산학협력 공동연구 및 신사업 추진
한미약품은 작년 12월 에퍼메드 테라퓨틱스(AffaMed Therapeutics)에 안과신약 후보물질 리수테가닙(Risuteganib, 제품명: 루미네이트®)의 중국내 판권을 이전하는 라이선스 계약을 체결한 바 있다. 리수테가닙은 2015년 한미약품이 전략적 투자를 단행한 미국 안과 전문 R&D 기업 알레그로(Allegro Ophthalmics LLC)가 개발한 망막질환 분야 신약으로, 한미약품은 한국과 중국에서의 개발 및 독점 판매권을 보유하고 있었다.
한미약품은 또 작년 6월 단국대와 내성 폐암 표적 혁신 신약 공동연구에 착수했으며, 학내 연구센터를 설립해 차세대 폐암 표적 발굴에 협력하고 있다. 또한 북경한미가 개발한 이중항체 플랫폼 펜탐바디(PENTAMBODY)를 적용한 차세대 항체-약물 접합체(antibody-drug conjugates, ADC) 공동연구 및 개발 협약을 레고켐 바이오사이언스와 체결 후 활발한 연구를 진행 중이다.
이 외에도 미래 성장동력 발굴을 위한 글로벌 연구개발 협력 및 R&D 네트워크 구축에도 힘을 쏟고 있다.
◆독자적 mRNA 플랫폼 확보…코로나 백신 포함 개발 영역 확대
이번 발표에서 권 사장은 한미약품이 자체 R&D 역량을 기반으로 독자적 mRNA 플랫폼을 성공적으로 개발했다고 공개하고, 코로나19 백신 개발뿐 아니라 대사성질환, 항암, 심혈관 및 신장계 질환, 효소대체 요법 등 분야에 이 mRNA 플랫폼 적용을 추진하고 있다고 설명했다.
한미약품연구센터는 한미정밀화학이 생산한 원료물질을 이용한 mRNA 플랫폼을 확보했으며, 코로나19 최근 변이에 대응할 수 있는 후보물질을 개발했다. 한미약품은 자체 도출한 코로나19 백신 후보물질(HM72524)이 다양한 변이 종에서도 우수한 중화 효과가 나타난다는 사실을 확인했으며, 이를 기반으로 빠른 시일내 임상승인을 신청할 계획이다.
이와 함께 한미약품은 이 mRNA 플랫폼을 기반으로 항암 백신, 대사성질환 및 의학적 미충족 수요가 높은 리소좀 축적 질환 등에 관한 연구에도 착수했다.
한미약품은 CDMO 비즈니스를 위해 평택 바이오플랜트를 기존 랩스커버리 제품뿐 아니라 mRNA 및 DNA 기반 바이오 의약품 대량 생산이 가능한 시설로 다각화해가고 있으며, 최근 인도 자이더스사 코로나19 DNA백신 위탁생산을 위한 기술이전 및 설비준비 계약도 맺었다.
또한 한미약품은 작년 6월 에스티팜, GC녹십자 및 KIMCo(한국혁신의약품컨소시엄)와 함께 차세대 mRNA 백신 플랫폼 기술 개발 및 백신 주권 확립 사업에 나섰다.
한미약품은 이렇게 축적한 mRNA 노하우가 코로나 팬데믹 이후에도 다양한 치료제 개발로 이어질 것으로 기대하며, 합성신약과 바이오신약에 이어 mRNA 기반의 다양한 치료제가 향후 한미약품의 신약 파이프라인을 구성하는 중요한 축이 될 것이라고 강조했다.
한미약품 권세창 사장은 “올해는 한미약품이 R&D 분야에서 획기적 성과를 보이는 한 해가 될 것으로 기대한다”며 “항암, 희귀질환, 대사성질환 등 기존 영역에서의 성과는 물론, mRNA 분야 등 새로운 혁신 분야에서 한미약품그룹의 강력한 신성장동력을 자체 연구와 오픈이노베이션을 통해 구축해 나가는 도약의 해로 만들겠다”고 말했다.











