식품의약품안전처(처장 오유경)는 의약외품 제조·품질관리기준(GMP)을 도입하기 위해 그 기준과 세부 운영 방안 등을 담은 「의약외품 제조 및 품질관리에 관한 규정」(식약처 고시) 제정안을 30일 행정예고하고, 6월 19일까지 의견을 받았다.
현재 의약외품은 의약품에서 전환된 일부 품목군(내용고형제, 내용액제, 식약처장이 고시한 표준제조기준에 맞는 외피용연고제・카타플라스마제)에만 의약품의 제조·품질관리기준을 의무 적용하고, 나머지 의약외품은 적용하고 있지 않고 있으나, 최근 의약외품의 관리에 대한 국민 기대 수준이 높아짐에 따라 나머지 의약외품에 대해서도 제조·품질관리기준 도입을 추진한다.
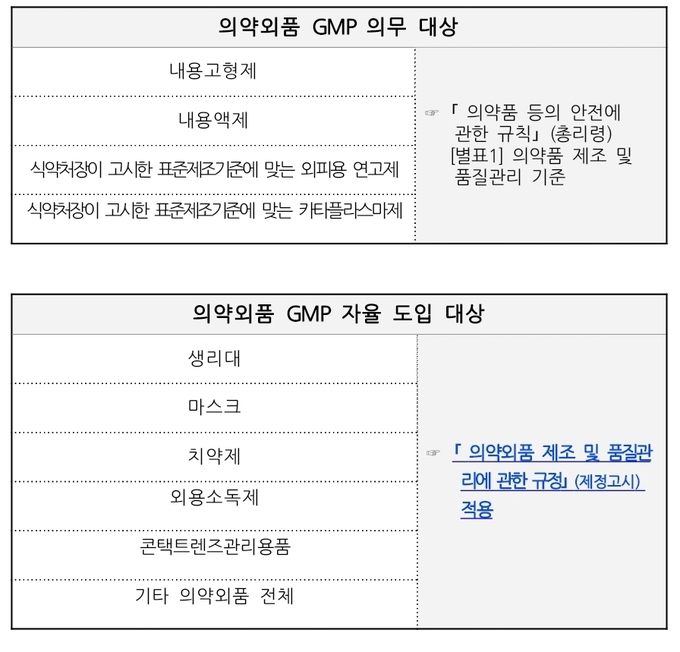
의약외품 업계 특성상 소규모 영세업체가 다수인 점을 고려해, 우선 원하는 업체를 중심으로 ‘의약외품 GMP 자율도입 제도’로 추진한다.
이번 고시 제정안에는 ▲의약외품 제조·품질관리기준(GMP)▲적용 대상의 범위 ▲적합판정 기준 및 요건, 신청절차 ▲적합판정, 보완 요구, 적합판정서 발급 ▲변경적합판정, 유효기간의 연장, 적합판정서 재발급 절차 ▲우대조치 및 사후관리 등에 관한 사항을 담았다.














