㈜헬릭스미스는 현재 진행 중인 엔젠시스(VM202)의 당뇨병성 신경병증(DPN) 임상 3상(3-2)에서 22일(미국시간) 152명의 환자가 등록되었다고 밝혔다. 이는 152번째 환자가 첫번째 주사를 받기 시작했다는 의미다. 헬릭스미스가 원래 임상 프로토콜 상의 최소 규모를 충족시켰다는 것으로서, 임상시험 분야에서는 매우 중요한 마일스톤으로 간주되는 사항이다. 엔젠시스(VM202)의 이번 DPN 3상(3-2)은 적응적 설계(adaptive design)에 기초한 것으로서 임상 규모는 최소 152명, 최대 250명으로 설계되어 있다. 이 디자인에서는 최소 대상자 수의 50%, 즉 76명에 대한 6개월 추적관찰 기간이 지난 다음에 IDMC(독립 데이터 모니터링 위원회)의 중간분석을 통해 그 규모를 최종 설정하게 되어 있었다. 이에 따라 지난 17일, IDMC는 헬릭스미스에게 이미 152명 등록이 가까운 시점이고 약물의 안전성 문제가 없으니 이미 등록된 모든 환자들에 대해 중간분석을 실시할 것을 권고했다. 이는 1) 최소 대상자 규모대로 임상시험 진행(152명), 2) 대상자 규모를 조정하여 임상시험 진행(153~250명), 3) 임상시험 대상자 등록 중단 등 3가
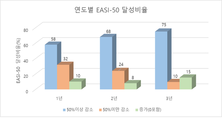
강스템바이오텍(대표 나종천)은 2019년 완료한 아토피피부염 줄기세포 치료제 ‘퓨어스템-에이디주’에 대한 임상3상(K0102)의 장기추적연구(K0102-E) 중간결과를 통해 투약 후 3년까지의 안전성과 유효성을 확인했다고 밝혔다. 본 연구는 식품의약품안전처의 가이드라인에 따른 것으로, 임상개발 중인 줄기세포 치료제의 5년 장기 안전성 추적이 주목적이다. 이에 강스템바이오텍은 5년간의 안전성 뿐만 아니라 3년까지의 유효성도 확인할 수 있도록 설계했으며, 안전성에 대한 연구는 5년이 되는 시점인 2023년 말까지 진행하여 최종화할 계획이다. 이번 장기추적연구(K0102-E)의 대상이 되는 임상시험은 2018년 4월부터 12월까지 실시했던 임상3상(K0102)으로 총 197명의 환자가 참여했으며 그중 98명이 시험약을 투여 받았다. 시험약을 투여 받은 환자 중 장기추적연구에 동의한 69명의 환자를 대상으로 36개월 동안의 안전성 및 유효성을 평가한 결과, 3년 시점까지 시험약과 연관된 사망이나 악성종양 등의 중대한 이상반응은 확인되지 않았다. 장기적 유효성을 분석한 결과 EASI-50 달성비율은 1년 시점 58%(69명 중 40명), 2년 시점 66%(50명 중

카나리아바이오 (대표이사 나한익)는 미충족 수요가 가장 높은 기존 치료 내성 난소암 환자 대상의 임상시험을 통해 난소암 치료제 시장 점유율 100%에 도전한다. 카나리아바이오는 연세대학교 세브란스병원 산부인과 이정윤 교수팀과 함께 재발성 난소암 환자의 치료를 위한 오레고보맙(Oregovomab)과 PLD(PEGylated Liposomal Doxorubicin) 병용요법 임상 환자모집이 개시되었다고 밝혔다. 이번 임상에서 카나리아바이오는 필요한 임상시험용의약품 제공 등을 통해 임상시험을 지원하게 되고, 이정윤 교수팀은 환자 모집, 약물 투여 및 데이터 도출 등 프로토콜에 따라 연구자 주도 임상시험을 진행하게 된다. 이와 관련하여, 이정윤 교수팀는 ‘백금 계열의 항암제 재치료에 적합하지 않은 PARP(Poly(ADP-ribose)polymerase: 암세포 DNA 수선 효소) 저해제 저항성 난소암, 난관암 또는 원발성 복막암 환자를 대상으로 오레고보맙 및 PLD를 평가하는 제 2상 임상시험’을 개시했다.. 이정윤 교수팀의 임상은, 현재 치료하기가 가장 어렵고 미충족 수요가 가장 높은 재발성 난소암 환자군을 대상으로 진행 중이다. 즉, 난소암 일차 관리약으로 사

카나리아바이오는 난소암 환자를 대상으로 진행하고 있는 오레고보맙의 글로벌 임상3상 환자모집이 60% 완료 되었다고 21일 밝혔다. 목표 환자 수는 602명이다. 이번 글로벌 임상3상은 보조항암요법과 선행항암요법 두개의 코호트(Cohort)로 나뉘어 진행되는데 FDA는 이중 하나의 코호트만 성공해도 신약 승인이 가능하다는 의견을 제시한 바 있다. 선행항암요법이 더 많이 쓰이고 있는 브라질과 인도 사이트들이 최근 추가 되면서 선행화학요법에 오레고보맙을 병용하는 코호트는 연말까지 환자모집을 완료할 수 있을 것으로 회사는 기대하고 있다. 보조항암요법에 오레고보맙을 추가하는 코호트의 경우는 내년 1분기까지 환자 모집을 완료 할 수 있을 것으로 예상된다. 이와 같이, 환자 모집이 목표치의 60%를 넘어서면서 중간결과 발표는 기존 예상대로 내년 3분기 중에 가능할 것으로 보인다. 카나리아바이오는 16개 국가 130개 사이트에서 환자 모집을 하기로 했던 계획이 코로나-19로 인해 환자 모집이 지연되면서 회사는 이를 만회하기 위해 최대 40개 사이트를 추가하겠다는 대책을 내놓은 바 있다. 현재는 총 16개국에 152개 사이트가 오픈 되었다.
㈜제넥신(대표이사 닐 워마, 우정원 095700)은 암 치료 DNA백신 GX-188E(성분명: 티발리모진 테라플라스미드), 그리고 면역항암제로 개발중인 GX-I7(성분명: 에피넵타킨 알파)과 BMS오노의 글로벌 면역항암제인 옵디보(성분명: 니볼루맙)의 삼중병용요법 연구자 주도 임상 2상 첫 환자 투약을 완료하였다고 16일 밝혔다. 본 임상은 연세암병원 종양내과 김혜련 교수가 주도하는 연구자 임상으로 총 21명의 HPV-16 또는 HPV-18 양성인 재발성/전이성 두경부 편평세포암(R/M HNSCC) 환자를 대상으로 GX-188E, GX-I7, 옵디보를 병용 투여하고, 이에 대한 유효성 및 안전성을 평가한다. 재발성/전이성 두경부 편평세포암은 예후가 안좋은 난치성 질환으로 구강인두 부위에 발병하기 때문에 발병 시 기능적 손실을 유발하는 등 환자들의 삶의 질에 큰 영향을 미치며 높은 사망률을 초래하기에 적극적 치료가 필요하다. 미국 국립보건원 (NIH)에 따르면, 두경부암에 속하는 구강인두암의 경우 미국내 환자 중 약 70%가 인유두종바이러스(HPV) 감염에 의해 발병한 것으로 보고 되었으며 국내에서도 이와 유사한 수치가 보고되어 있다. 이와 같이 HPV양성

대웅제약(대표 전승호·이창재)은 미국 식품의약국(FDA)으로부터 자가면역질환 신약 후보물질 DWP213388의 임상 1상 시험 계획(IND)을 승인 받았다고 11일 밝혔다. 대웅제약은 이번 임상 1상에서 DWP213388의 안전성, 내약성, 약동학 및 약력학 특성을 확인하고 유효성 탐색을 목적으로 하는 임상 2상 진입의 가능성을 확보한다는 계획이다. 이번 임상 1상 시험은 올해 4분기 시작 예정으로 건강한 성인 80명을 대상으로 단회 투여와 반복 투여로 진행된다. DWP213388은 혁신 신약(First-in-class)으로 대웅제약이 개발 중인 자가면역질환 경구용 치료제다. 일반적으로 B 세포(B cell) 또는 T 세포(T cell) 하나만의 저해에 국한되어 있는 기존 치료제와는 달리 DWP213388은 B세포와 T세포를 동시에 저해하는 이중표적 저해제로 우수한 약효를 갖는 것이 큰 특징이다.

카이노스메드(284620)는 파킨슨병 치료제(KM-819) 미국 임상 2상 첫 과정인 Part 1의 대상자 모집과 등록을 마치고 첫 투여를 시작했다고 9일 밝혔다. 미국 로스엔젤레스 근교 글렌데일에 위치한 파렉셀임상센터 병원에서 진행되는 임상시험은 최대 허용 용량치 결정을 위해 투여량을 전보다 늘려서 임상을 하는 Part 1과 288명의 환자를 대상으로 2년간 투여하여 치료 효과를 확인하는 Part 2로 구성되어 있다. 지난해 11월 미국 FDA로부터 승인을 받았으며 이번 임상이 성공하여 치료효과가 확인 되면 임상3상을 거쳐 세계 최초의 파킨슨병 치료제 개발로 이어지게 된다. KM-819는 세포의 죽음을 촉진하고 파킨슨병 환자의 뇌세포에서 과별현하는 FAF1이라는 단백질을 타겟으로 새로운 메커니즘에 근거한 혁신형 신약 후보 물질이다. 뿐만 아니라 세포내에서 잘못 형성된 불필요한 단백질의 분해를 촉진하는 메커니즘도 있음이 밝혀진바 있다. 도파민 신경세포를 보호하고 알파시뉴클레인을 분해하는 효능은 다른 약물에서 볼 수 없는 KM-819만이 가진 특징이다. 현재 다른 단백질을 타겟으로 한 약물들이 아직 임상에서 효과를 못내고 있다는 점에서 큰 기대를 받고 있다.

LG화학이 글로벌 통풍 치료제 시장에 진출하기 위한 최종 임상단계에 본격 착수한다. LG화학이 자체적으로 미국 등 글로벌 지역서 신약 임상 3상에 나서는 건 이번이 처음으로, 내수 및 신흥국 시장 중심의 바이오 사업영역을 미국, 유럽 등으로 대폭 확장한다는 전략이다. LG화학은 1일 미국 FDA에 자체개발 통풍신약 ‘티굴릭소스타트(Tigulixostat)’ 임상 3상(연구 과제명; EURELIA_1 Study) 시험계획을 신청했다고 밝혔다. 이번 임상은 위약 대조군 비교 시험으로 LG화학은 미국을 포함한 다국가 지역 고요산혈증 동반 성인 통풍 환자 350명을 대상으로 복용 6개월째 약물의 유효성 및 안전성을 평가할 계획이다. 1차 평가 지표는 6개월째 혈청요산농도 6mg/dL에 도달하는 환자의 비율로 설정했다. 이와 함께 LG화학은 고요산혈증 통풍환자 1차 치료제 성분인 ‘알로푸리놀(Alopurinol)’과의 비교 시험 계획도 미국 FDA에 추가 신청할 예정이다. 글로벌 대규모 시험군 모집을 통해 차별화된 효능과 장기 복용 안전성 등을 입증한다는 전략이다. * 1차 치료제 : 약물치료 시 가장 먼저 처방을 권고하는 약물. 약물의 안전성 등을 고려해 처방 단계

큐라티스는 개발하고 있는 청소년 및 성인용 결핵 백신 신약 ‘QTP101’의 후기 임상 시험에 착수한다. 식품의약품안전처(이하 식약처)는 QTP101 결핵 백신의 다국가 2b/3상 IND(임상 시험 계획)를 2022년 7월 21일 자로 승인했다. 큐라티스는 국내 최초로 진행한 성인 대상 2a상 임상 시험 및 청소년 대상 1상 임상 시험에서 임상적으로 우수한 내약성과 안전성 프로파일을 확인했고, QTP101 결핵 백신이 위약 대비 강력한 면역원성을 형성하고 지속 유지했음을 확인한 바 있다. QTP101 결핵 백신은 결핵 항원과 합성 면역 증강제로 구성돼 있으며, 결핵 항원의 경우 결핵균(Mycobacterium tuberculosis)에서 유래한 4종의 병독성 및 잠복성 단백질을 유전자 재조합 기술로 만든 재조합 융합 단백질 항원이다. 면역 증강제는 백신 효능 강화와 함께 적은 양의 항원으로도 충분한 면역력을 발휘할 수 있도록 돕는 Adjuvant 역할을 한다. 이번 2b/3상 후기 임상 시험은 1단계(2b상)의 중간 분석 결과를 바탕으로 연속적으로 2단계(3상) 임상 시험을 수행하게 된다. 1단계 및 2단계의 베이스라인 시점에서 잠복 결핵 감염 검사(QFT)
코넥스트는 재조합 콜라게네이즈 기반 치료제인 CNT201에 대한 IND 패키지 개발에 착수하였으며 2022년 중 미국 FDA에 임상시험계획서를 제출할 계획이라고 ‘2022 대한민국 바이오 투자 콘퍼런스’를 통해 밝혔다. CNT201은 2종의 고순도 콜라게네이즈로 구성되는 복합제형 제품으로, 유전자재조합 기술을 통해 제조되어 동물성 원료를 사용하지 않으며 혁신적인 제형기술을 통해 경쟁력을 확보한 best-in-class 제품이다. 코넥스트는 듀피트렌구축과 페이로니병, 미용성형 분야의 셀룰라이트 등 3가지 적응증에 대한 치료제로서 CNT201을 개발하고 있으며, 임상단계 진입에 필수적으로 요구되는 GLP 독성시험과 GMP 임상시험용의약품을 제조를 국내외 CRO 및 CMO와 함께 성공적으로 완료하였다. 확보된 비임상 및 CMC 데이터를 기반으로 2022년 4분기 중 듀피트렌구축에 대한 임상시험계획서 (IND)를 미국 FDA에 제출하고 2023년 중 투약을 개시할 계획이며, 전략적 임상설계를 바탕으로 2개의 추가 적응증(셀룰라이트, 페이로니병)에 대한 임상시험계획서를 순차적으로 미국 FDA에 제출할 예정이다. 타겟 적응증은 미국에서 4억3천만불 수준의 시장을 형성하